上野 高史 先生(福岡記念病院)
池田 隆徳 先生(東邦大学大学院医学研究科循環器内科学)
矢坂 正弘 先生(国立病院機構九州医療センター)
バイエル薬品株式会社提供 インターネット座談会
2020年9月12日(土) 13:00 ~ 15:00
高齢化が進む中、心房細動(AF)患者は増加の一途をたどり、虚血性心疾患を合併したAF患者も増えている。そうした中、2019年にこれら患者の抗血栓療法に関する新たなエビデンスとしてAFIRE試験[1]がThe New England Journal of Medicineに報告された。この結果から実臨床ではどのように考え、またどのようなことに注意すべきかをディスカッションしていただいた。
De-escalation時代の幕開け~足し算から引き算の治療戦略へ
中村:
虚血性心疾患を合併したAF患者では虚血リスクと出血リスクのバランスを考慮した抗血栓療法が重要となりますが、近年のステントの進歩とともにステント血栓症リスクが低下したこともあり、今日では出血リスクの低減に主軸をおいた治療戦略が世界的な潮流となってきています。
その契機ともいえるのが2019年にAcademic Research Consortium(ARC)が提唱した経皮的冠動脈インターベンション(PCI)施行時の高出血リスク(HBR)の概念です[2]。
PCI後1年以内のBARC出血基準が3または5の出血リスクが4%以上、または頭蓋内出血リスクが1%以上をHBRと定義し、ARC-HBR評価基準の大基準1項目以上、または小基準2項目以上に該当するものをHBRとしました。例えばOACの服薬は大基準に該当するためHBRとなります。
実際、日本人PCI施行患者約6,000例以上を対象としたPENDULUM試験[3]では、OACを服薬している患者では年率4%以上の大出血、1%以上の頭蓋内出血を認めています。
このようなことから出血リスク低減には、抗血栓薬をできるだけ減らす「de-escalation」が主な治療方針になります。
冠動脈疾患を有するAF患者における抗血栓療法
池田:
FUSHIMI AF registry[4]、CREDO-Kyoto Cohort2[5]のデータを見ると、AF患者の15%は冠動脈疾患(CAD)を合併しており、その約半数強はPCIを受けています。また、中国から提唱された心房細動の発現リスクを予測するC2HESTスコア[6]やREACH registry[7]などをみても、AFとCADは密接に関係し、予後にも大きなインパクトを与えることがわかります。
CADとAFを合併すると、抗血小板薬と抗凝固薬の併用が必要となりますが、両者の併用により出血リスクが増加するのが課題でした。そこで、これらの課題に対する様々な研究が行われてきました。
例えば抗血小板薬2剤と抗凝固薬の3剤併用療法と抗血小板薬と抗凝固薬との2剤併用療法を比較したWOEST試験[8]では、明らかに前者のほうが出血の発現率が高いのみならず、心血管イベントの発現率も増加することが分かりました。
上野:
2017年に発表されたESCのガイドライン[9]で画期的であったのは、OACを必要とするPCI施行後のアルゴリズムとして、池田先生が言及されたWOEST試験、さらにはリバーロキサバンを用いたPIONEER AF-PCI試験[10]の結果を踏まえ、高出血リスクでは最初からOACとクロピドグレルの2剤併用療法を推奨したことです。
その後、発表された各DOACの臨床試験の結果も、本ガイドラインの推奨を支持するものとなっています。
池田:
国内においても新しく改訂された不整脈薬物治療ガイドライン[11]では、冠動脈ステント留置患者における3剤併用療法は原則、周術期(2週間以内)にとどめ、出血リスクが高い患者に対する1か月以上の3剤併用療法をクラスⅢ、すなわち事実上の禁忌にしていることも思い切った判断といえると思います。
上野:
一方、PCI施行1年以降については、心筋梗塞やPCI施行1年以降のAF患者の抗血栓療法を検討したデンマークのレジストリー[12]などの観察研究の結果、有効性及び安全性の点で、2剤併用療法はワルファリン単剤を凌駕するものではないことが示されました。
これらを根拠にESCをはじめとする各種ガイドラインではOAC単剤療法を推奨してきましたが、ランダム化⽐較試験(RCT)によるエビデンスは欠如していました。
そのような中、日本発のランダム化⽐較試験(RCT)であるAFIRE試験[1]により、「de-escalation」という新たな治療戦略をエビデンスとして示したことは、⼤変意義深いものと考えています。
池田:
PCI施行後を対象としたDOACの試験は、ESCをはじめとするガイドラインに大きな影響を与えつつ、データがなかったPCI後12か月以降の抗血栓療法に対しては、AFIRE試験が足し算の時代から引き算の時代へ突入する一石を投じたのではないかと思います。
De-escalationの意義をエビデンスとして示したAFIRE試験
中村:
いまお話しにもあがりましたようにAFIRE試験は、まさにこの「de-escalation」がキーワードになります。
この試験では、PCI/冠動脈バイパス術(CABG)後1年以降、あるいは冠血行再建術を必要としない安定冠動脈疾患(CAD)を有する日本人AF患者を対象とし、リバーロキサバン単剤とリバーロキサバンに抗血小板薬1剤を加えた併用療法が比較検討されました。

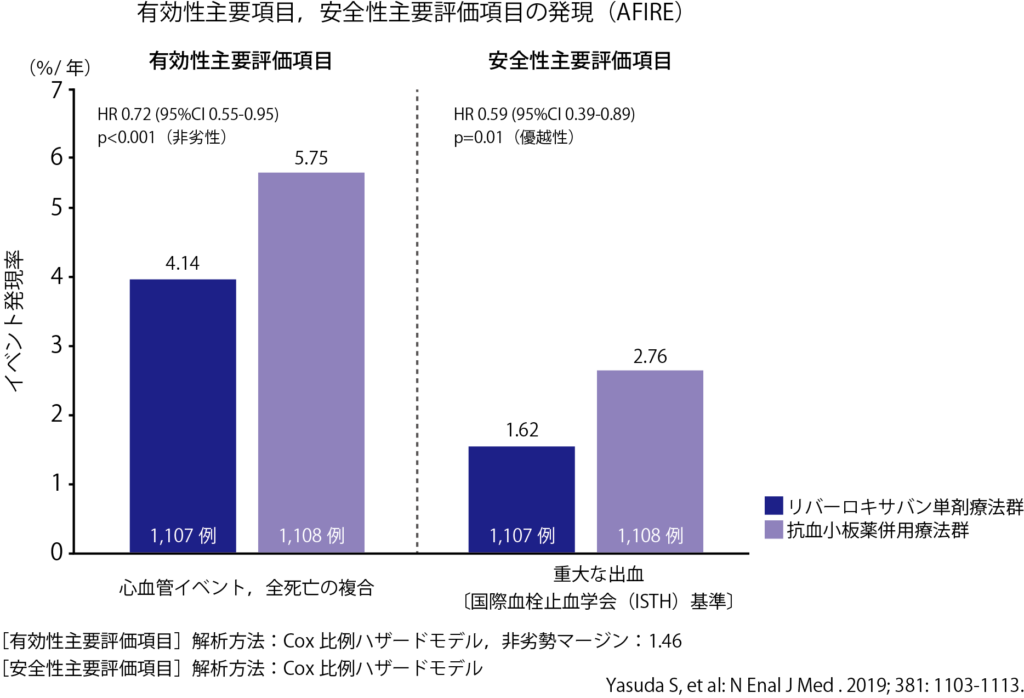
その結果、安全性主要評価項目である重大な出血(ISTH基準)の発現は、試験開始初期から差を認め、併用療法群に対するリバーロキサバン単剤群の優越性が示されました(HR 0.59、95%CI0.39~0.89、優越性のP=0.01)(図右)。さらに有効性主要評価項目である心血管イベントと全死亡の複合についても非劣性(HR0.72、95%CI 0.55~0.95、非劣性マージン1.46、非劣性のP<0.001)が検証されました。これらの結果はステントの種類、HAS-BLEDスコアやCHA2DS2-VAScスコアなどに影響を受けず、一貫していることも確認され、その意義は大きいと考えています。
2020年3月には、AFIRE試験をはじめとした近年のエビデンスに基づき、CAD患者における抗血栓療法のフォーカスアップデートが行われました[13]。
PCI施行患者では、まずはHBRかどうかを評価し、続いてOAC服薬例かどうかを評価します。OAC服薬例では、抗血小板薬をふくむ3剤併用は2週間以内、可能な限り入院中のみとし、それ以降は抗凝固薬とP2Y12 受容体拮抗薬の2 剤併用療法、すなわちWOESTライクとし、1年以降はOAC単剤療法、すなわちAFIREライクを推奨するというものです。
上野:
今回改訂されたわが国のガイドラインは、AFIREをはじめとする本邦からの臨床試験の成績や大規模臨床試験の成果を反映し、非常に洗練されたものとなっています。冠動脈ステント留置患者ではAFがあった場合、ワルファリンではなくDOACの投与が推奨クラスⅠになったことも大きな特徴です。
ただし、全てのDOACでAFIREの結果が当てはまるのか、つまりPCI施行1年目以降をDOAC単剤にした際に、すべてのDOACでリバーロキサバン同様の血栓性イベント抑制効果が期待できるのかは興味のあるところです。
脳卒中専門医から見たAFIRE試験
中村:
脳梗塞の既往がある二次予防のAF患者さん、特に抗血小板薬を併用されるような症例の抗凝固療法についてはいかがでしょうか。
矢坂:
まず当施設の状況をお話ししますと、脳卒中急性期の方の8割が脳梗塞で、確定診断がついた患者では心原性、アテローム血栓性、ラクナ梗塞がおよそ1対1対1という状況となっています。心原性脳梗塞における基礎心疾患の9割以上が非弁膜症性心房細動で、退院時には抗凝固療法は90%に施行されます。基本的にDOACを選択しますが、投与できないケースではワルファリンを処方します。
では、ラクナ梗塞やアテローム血栓性脳梗塞に心房細動を合併した場合、抗凝固薬と抗血小板薬の併用が必要かということになりますが、我々は抗凝固薬単独で治療する方針を支持してきました。また、脳領域では頸動脈ステント留置術が普及してきています。当院では、ステント留置後はDAPTを原則6か月、出血リスクが高ければ3か月でそれ以降は単剤としています。
AFがあればDOACと抗血小板薬1剤を6か月間、出血や血腫のリスクが高い場合は3か月、その後はDOAC単独に切り替えています。
日本で行われたBAT試験[14]で、抗血小板薬単剤に比べ抗血小板薬を2剤に増やすと、あるいはワルファリン単剤に比べ、抗血小板薬を併用すると大出血のリスクはそれぞれ約2 倍に増加することが示されました。
そのため、できるだけ抗凝固薬と抗血小板薬の併用を避けるようにし、頭蓋内出血のリスクとなる血圧などのリスク管理を徹底的に行っています。
また、脳領域では2000年代にWASID試験[15]やWARSS試験[16]でアテローム血栓性脳梗塞などの非心原性脳梗塞に対し、ワルファリンと抗血小板薬で有効性に有意な差を認めませんでした。これらの結果を受け、血小板療法を必要とする心房細動患者さんでは、原則ワルファリン単独にするというのが一般的でした。
今回のように心房細動患者さんがCADを合併した場合、脳梗塞の既往があれば、脳梗塞の再発や頭蓋内出血のリスクは2倍に上昇することを考慮し、脳梗塞二次予防の立場から、頭蓋内出血リスクの徹底的な管理の一つとして抗血栓薬の併用をなるべく避けつつ、抗凝固薬として頭蓋内出血の少ないDOACを積極的に使っています。
高齢・腎機能低下AF患者における抗血栓療法
中村:
脳梗塞を起こしていない一次予防のAF患者さんにおける抗血栓療法についてはいかがでしょうか。
池田:
一次予防においても最近はDOACが主流になってきていますが、重要なのは各薬剤に設定された減量基準を守って適切に投与することだと思います。日本の医療の特徴としてunder-doseが多いといわれています。
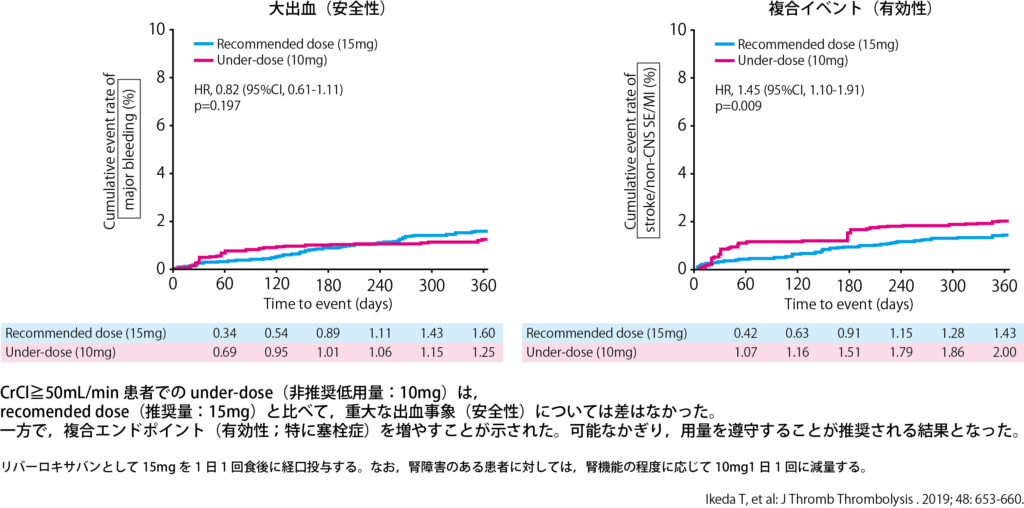
しかし、様々な研究でunder-dose(不適切な減量)では塞栓イベントが増えることが報告されています。リバーロキサバンの特定使用成績調査であるXAPASS[17]でも、under-dose群では、適正用量群に比べ、重大な出血の発現は変わらないが、脳卒中や全身性塞栓症はunder-dose群で増加することが報告されています。
また、高齢者や、抗血小板薬との併用例では用量を低めに処方しがちですが、XAPASSの年齢別の解析結果や、AFIRE試験のデータを見る限りは添付文書通りの用量で処方することで問題ないと考えています。
上野:
リバーロキサバンについては海外のROCKET AF試験[18]だけをみると安全性について少し不利な印象を持っていました。
しかし、日本の特定使用成績調査であるXAPASSの高齢者や腎機能低下例の結果、さらには今回のAFIRE試験の結果などを踏まえると、日本人に対する安全性について印象が変わったのは事実です。海外のデータと日本のデータでは少し違った印象をもっています。
中村:
XAPASSでは高齢者や腎機能低下例においても安全性が示されているということですが、実際に先生方の臨床上の実感としてはどうでしょうか。
矢坂:
リバーロキサバンにおいてはXAPASSで示された結果が、私の臨床での経験と合致していると感じています。
有効性もですが、安全性についても頭蓋内出血で搬入されてくる方を経験することも極めて少ないので、XAPASSの結果と同じ傾向が一般の臨床現場でも見られているのが現状だと思います。
上野:
われわれ循環器医にとって予防薬というのは、つい安全性に重きを置きがちなのですが、それは有効性が担保されたうえでの安全性であるべきで、そのバランスを見極めることが大切だと思っています。
実診療における出血リスクの管理
中村:
実際の診療において、出血を減らす工夫としてどのようなことを心掛けておられるでしょうか。
矢坂:
出血性合併症として、多いのは頭蓋内出血と消化管出血です。消化管出血については、上部消化管出血ではピロリ菌の存在やNSAIDの併用などが関係することが多いので、それらのリスクを管理することが大切です。
下部消化管については定期的な健診が一番です。頭蓋内出血については、厳格な血圧管理につきます。
BAT試験では、頭蓋内出血を起こした患者では発現までの経過観察中に血圧上昇が観察されており、頭蓋内出血発現cut-off値をSBP/DBP 130/81mmHgと報告しています[14]。
そのため、我々の領域では、血圧は常に130/80mmg未満で管理することを念頭に診療にあたっています。高血圧を含め、高血糖、過剰のアルコール摂取、喫煙の4項目については積極的に介入すべきリスク因子として管理すると共に、抗血栓薬の併用をできるだけ避けるように心がけています。
上野:
われわれも血圧管理に気を付けています。もう一つは、自分でも最近必ず実践するようにしたのは、高齢の方に限らず眼瞼結膜を見て貧血をチェックすることは必ず実践しています。
池田:
AFは血圧だけでなく、ストレスが大きなリスクファクターになります。飲酒、たばこといった生活習慣の改善が重要だと思います。
中村:
OMT(optimal medical therapy)はlife modificationが含まれるということになっていますので、血圧管理、脂質管理、糖尿管理を含めて生活スタイルのmodificationが極めて重要ということは、AF例においても変わらないということですね。
日本におけるエビデンス創出
中村:
DOACの中でもリバーロキサバンは日本人独自の用量が設定されているのが特徴ですが、この点はどのように解釈されますか。
池田:
日本人用量が設定されていることは非常に意味があると思います。日本人を対象としたJ-ROCKET AF試験[19]にはじまり、その後のXAPASS、EXPAND[20]、AFIRE試験のデータはアジア各国にも大きな影響をもたらしています。例えば台湾ではJ-ROCKET AF試験の結果を鑑み、海外での用量に加えて、日本人での用法・用量も承認されています。今後も日本からこうしたエビデンスを発信していけたらよいと思っています。
矢坂:
海外と日本のデータを比較する際には、日本人を含む東アジア人はワルファリン療法中の頭蓋内出血発現率が白人の4倍高いことが報告されており、頭蓋内出血を起こしやすい民族であることも考慮しなくてはなりません。
また、欧米人と日本人の体格差を考えると日本人に対して適切な用量が設定され、臨床研究で日本人のエビデンスを積み重ねてきたことは意味があることだと思います。
上野:
これまで日本では、欧米に追従する型で医療が行われてきたところがあると思います。しかし、日本独自の用量を設定して、実際の臨床現場において、日本人にとってはそれが適切であったことが示されることが、とても重要なことだと思います。
中村:
リバーロキサバンでは、日本独自の用量を設定したことの妥当性がXAPASSをはじめとして示されました。また、AFIRE試験で日本発エビデンスを世界に向けて発信できたことは、さまざまな領域にインパクトを与え、このように各領域の先生方と意見を共有することで、DOACの新たな一面も見えてきたのではないかと思います。先生方、本当にありがとうございました。
文献
[1] Atrial fibrillation and ischemic events with rivaroxaban in patients with stable coronary artery disease (AFIRE): Protocol for a multicenter, prospective, randomized, open-label, parallel group study. Yasuda S, et al. Int J Cardiol. 2018 Aug 15;265:108-112.
[2] Defining High Bleeding Risk in Patients Undergoing Percutaneous Coronary Intervention. Urban P, et al. Circulation. 2019 Jul 16;140(3):240-261.
[3] High Bleeding Risk and Clinical Outcomes in East Asian Patients Undergoing Percutaneous Coronary Intervention: the PENDULUM Registry. Nakamura M, et al. EuroIntervention. 2020 Jul 7;EIJ-D-20-00345. doi: 10.4244/EIJ-D-20-00345. Online ahead of print.
[4] Current status of clinical background of patients with atrial fibrillation in a community-based survey: the Fushimi AF Registry. Akao M, et al.J Cardiol. 2013 Apr;61(4):260-6.
[5] Anticoagulant and antiplatelet therapy in patients with atrial fibrillation undergoing percutaneous coronary intervention. Goto K, et al. Am J Cardiol. 2014 Jul 1;114(1):70-8.
[6] A Simple Clinical Risk Score (C 2 HEST) for Predicting Incident Atrial Fibrillation in Asian Subjects: Derivation in 471,446 Chinese Subjects, With Internal Validation and External Application in 451,199 Korean Subjects. Li YG, et al. Chest. 2019 Mar;155(3):510-518.
[7] Prevalence, clinical profile, and cardiovascular outcomes of atrial fibrillation patients with atherothrombosis. Goto S, et al. Am Heart J. 2008 Nov;156(5):855-63, 863.e2.
[8] Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open-label, randomised, controlled trial. Dewilde WJ, et al. Lancet. 2013 Mar 30;381(9872):1107-15.
[9] 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS) . Valgimigli M, et al. Eur Heart J. 2018 Jan 14;39(3):213-260.
[10] Prevention of Bleeding in Patients with Atrial Fibrillation Undergoing PCI. Gibson CM, et al. N Engl J Med. 2016 Dec 22;375(25):2423-2434.
[11] 日本循環器学会/日本不整脈心電学会:不整脈薬物治療ガイドライン(2020年改訂版)https://www.j-circ.or.jp /guideline/pdf/JCS2020_Ono.pdf(2020年3月閲覧)
[12] Antiplatelet therapy for stable coronary artery disease in atrial fibrillation patients taking an oral anticoagulant: a nationwide cohort study. Lamberts M, et al. Circulation. 2014 Apr 15;129(15):1577-85.
[13] JCS 2020 Guideline Focused Update on Antithrombotic Therapy in Patients With Coronary Artery Disease. Nakamura M, et al. Circ J. 2020 Apr 24;84(5):831-865.
[14] Dual antithrombotic therapy increases severe bleeding events in patients with stroke and cardiovascular disease: a prospective, multicenter, observational study. Toyoda K, et al. Stroke. 2008 Jun;39(6):1740-5.
[15] Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis. Chimowitz MI, et al. N Engl J Med. 2005 Mar 31;352(13):1305-16.
[16] A comparison of warfarin and aspirin for the prevention of recurrent ischemic stroke. Mohr JP, et al. N Engl J Med. 2001 Nov 15;345(20):1444-51.
[17] Real-world outcomes of rivaroxaban treatment in elderly Japanese patients with nonvalvular atrial fibrillation. Kitazono T, et al. Heart Vessels. 2020 Mar;35(3):399-408.
[18] Efficacy and safety of rivaroxaban in patients with diabetes and nonvalvular atrial fibrillation: the Rivaroxaban Once-daily, Oral, Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation (ROCKET AF Trial). Bansilal S, et al. Am Heart J. 2015 Oct;170(4):675-682.e8.
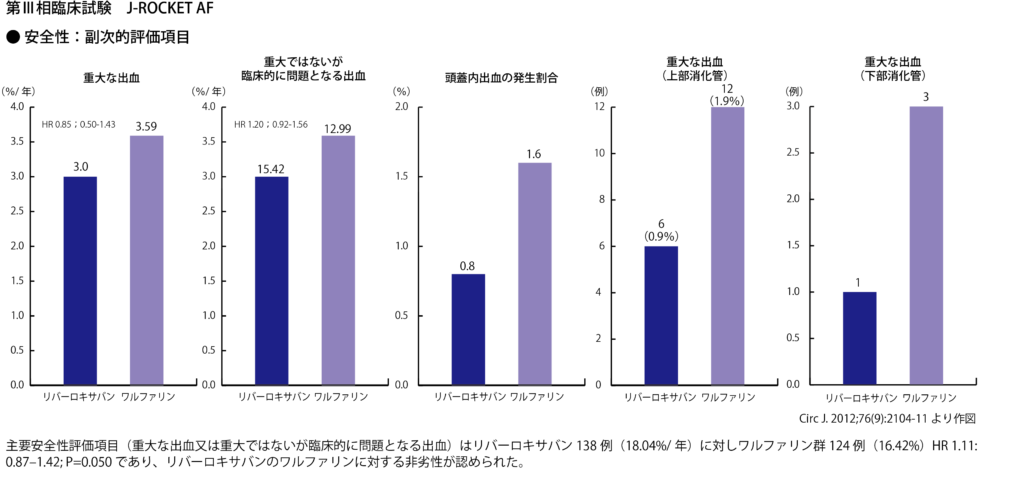
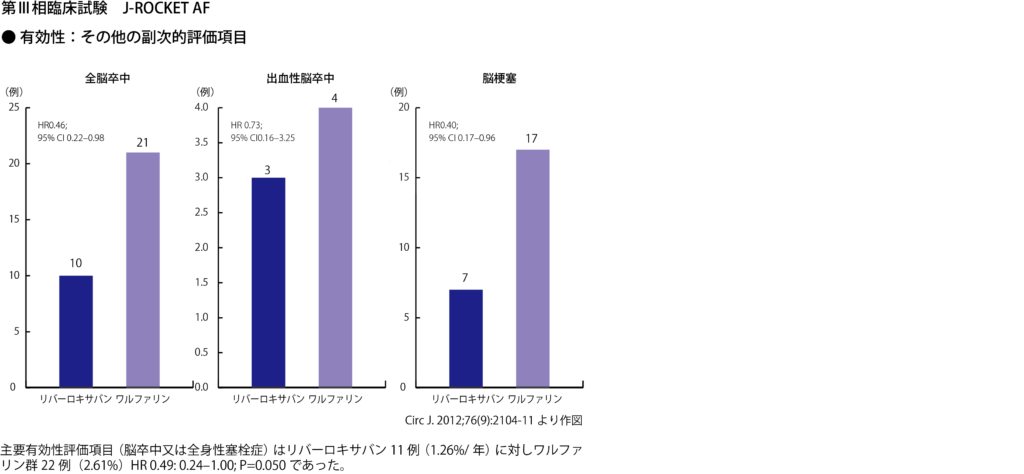
[19] Rivaroxaban vs. warfarin in Japanese patients with atrial fibrillation – the J-ROCKET AF study –. Hori M, et al. Circ J. 2012;76(9):2104-11.
[20] The EXPAND study: Efficacy and safety of rivaroxaban in Japanese patients with non-valvular atrial fibrillation. Shimokawa H, et al. Int J Cardiol. 2018 May 1;258:126-132.
【添付文書情報はこちら】
https://pharma-navi.bayer.jp/omr/online/product_material/XAR_MPI_TAB_202002030_1580225108.pdf
PP-XAR-JP-2129-22-12