池田浩治:東北大学病院臨床研究推進センター
石井健介:医薬品医療機器総合機構
上野高史:福岡記念病院
香坂 俊:慶応義塾大学
鈴木由香:東北大学病院臨床研究推進センター
里見智美:PMDA医療機器品質管理・安全対策部、安全性情報・企画管理部
土井功夫:㈱グリーンフィールド
俵木登美子:一般社団法人くすりの適正使用協議会
中井清人:厚労省厚生労働省 医薬・生活衛生局 医療機器審査管理課
横井宏佳:福岡山王病院循環器内科 (50音順・敬称略)
今回のあすなろ会は、2020年でインパクトのあった出来事を振り返りつつ、未来志向の産官学の取り組みはどのようにしていくのかを討論いたしました。
社会がこのような状況ですので、残念ながら一部の先生方はオンラインでのご参加となりましたが、皆様にご参加いただいて貴重な意見を多数いただきましたことに感謝申し上げます。
NPO法人リアルワールドデータを構築し明日の医療を支援する会
理事長 中村正人
メタ解析の衝撃
中村:
2年前(2018年12月)、ギリシアのKatsanos先生が報告した「EVT後の死亡率において1年目はパクリタキセル関連デバイスとコントロールでは全く差がないが経時的にその差が開いていく」というメタ解析の結果で世界中が大混乱に陥りました。
最大のインパクトは、死亡率が約2倍の差がついてしまったことです。死亡というハードエンドポイントであるためこうなるとFDAも動かざるをえません。
そこでFDAは、2019年の6月にピボタル試験のデータを独自に解析してパネルを開きました。その解析データではハザード比が1.7であり、議論によってもシグナル否定困難ということになり、FDAは添付文書の改正へと動きます。
また、FDAはそのパネルで米国以外の国では成績に差がないことを報告しています。しかし、症例数があまりにも少なくフォローアップも十分ではないので、このパネルではあくまでも参考程度とされています。
さて、このメタ解析の結果について、皆さまはどうお感じでしょうか。現場では実感がわきませんし、解析がおかしいのではないかとさえ思えてきます。
上野:
違和感でしかなかったですね。ただ同時に、これが真実だったら大変なことになるかもしれないという危機感も感じたことを覚えています。
横井:
私も最初は「これはいったい何事か」と耳を疑いました。確かにIN.PACTのデータではパクリタキセルと非パクリタキセルで差が大きいですが、これはメーカー側から説明を受けていますし、KOLの米国の医師に聞いても死亡率の差はバイアスと思われるので市販後調査(PMS)で調べていくという話でした。
ところが発表されたメタ解析は全く違っていて、ただただ違和感のみです。
土井:
臨床試験等を企画する企業の立場としても、この結果は驚きです。われわれのOPCとは全く異なる仕組みであるとしても、こういうこともありうるということを頭に置いていかないといけないという感想を持ちました。
鈴木:
薬物動態から考えるとパクリタキセルの塗布量が少なく、血中濃度もすごく低いので、本当にそうなのだろうかと私も感じました。当時は死亡原因が全くわかっていなかったはずですし、死亡原因が不明の状態で何がわかるのだろうというのが率直な意見です。
石井:
本邦でのCypher承認後に2006年にESC、欧州の心臓病学会での発表と同様という印象でした。PMDAの医療機器審査部としてもこの報告は気になりましたが、Cypher時と同様に日本人のデータではありませんし、Cypher PMSなどの市販後データを見守ったように、今回も日本人データを確認しながら、日本での安全対策を進めていくべきだろうと個人的には思いました。
里見:
真っ先に思ったのは、現場の先生の考えを確認したいということでした。世界的な論文とはいえ、先生方の感触は大事にしたいということがありますから。
中村:
こういう論文が出てFDAが動いていますが、日本はどう動くのでしょうか。
中井:
メタ解析はエビデンスが高く見えてしまうとはいえ、FDAのデータは本当にショッキングに見えました。日本での対応を考えると、一つ言えることは、現場感覚を無視して対応をすることは一般的には無いと思います。
俵木:
私もこんなことがあるわけがないというのが最初の印象でした。FDAの初動の速さには驚きましたが、その数か月後にPMDAが「事実として受け取り検討していく」と声明を出したのは、現場の混乱を防ぐ意味でも適切だったと思います。
中村:
日本の当局は「慌てず前向きに検証していきますよ」と、冷静に対応したということですね。
石井:
日本もけっこうスピーディに対応したと思います。また、審査部でも他のパクリタキセルコーティングデバイスの審査については、申請資料に基づき淡々と進めようという感じで議論していたことを覚えています。
里見:
正直なところ、規制当局としてはどうしても気になる話題です。FDAの声明を聞いた時は「どういうことだ」という気持ちはあったのですが、われわれは冷静に議論して、淡々と進めていこうと考えていたのです。
中村:
治験ではシグナルがあったことを患者さんに伝えないわけにはいかないので、同意文書の変更が必須になったということが日本における影響と言えるでしょうか。それでも大きな混乱もなく、われわれが平静でいられたのはCypherの経験があったからかもしれませんね。
結果の解釈において指摘された問題点とは
中村:
メタ解析に用いられた各試験は死亡率を検出するために設計されたものではありません。5年のフォローは3試験のみで、イベント数も27症例、死亡例が27例です。また、途中で脱落症例が多くみられて、それが成績を左右していたということです。
交絡因子の調整もされていませんし、因果関係が説明困難です。これではたとえ結果が出たとしても偶然という可能性が排除できません。加えて、米国とその他の国での成績に差があるということも指摘されています。
日本としては、自国での検証が望ましいわけです。理想は前向きランダム試験ですが、おそらく1万例近い大規模試験が必要でしょうから資金的にも時間的にもハードルが高いでしょう。
そして、現在の症例の前向き調査では選択バイアス回避のためにRCTが必要です。過去の症例を後ろ向きに調査してもやはり選択バイアスがかかるので、これではたとえデータが出ても評価が難しいということになりました。
そこですでに前向きに登録されている試験を集めて患者レベルでのメタ解析、それがGCPとGPSPを遵守していれば試験の質はある程度担保されるだろうという結論に至りました。
この解析に協力してもらえたのは6社で、12の臨床試験が該当するということになりました。守秘義務契約のもとに6社からデータを提供いただき、東北大学で解析を行いました。
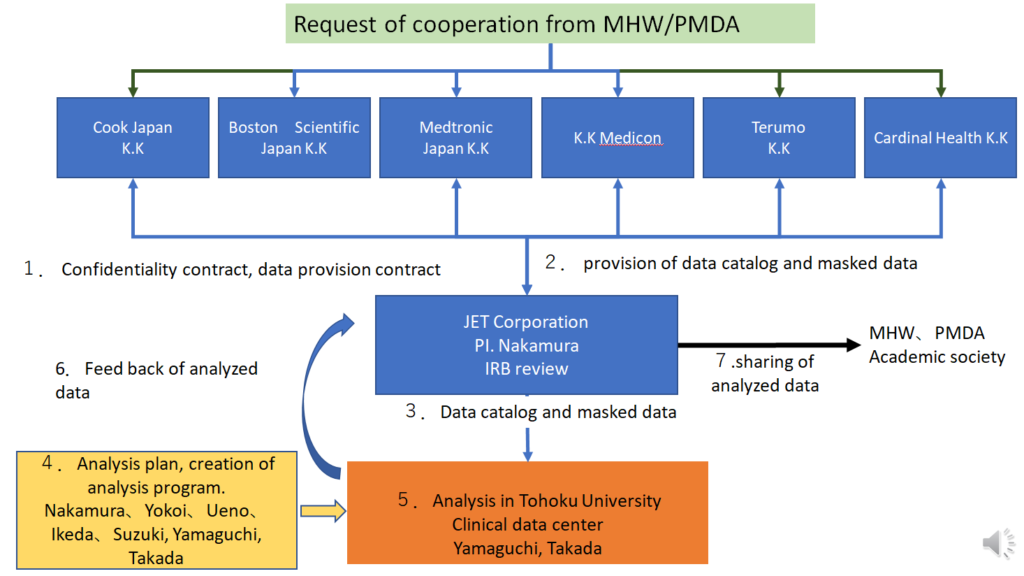
解析にあたり、東北大学の先生方には大変ご苦労をおかけしました。ようやくファイナライズというところまで来ていますが、思った以上に難事業だったということはお伝えさせていただきたいと思います。
日本では、2010~13年に行われている12試験2,581例(ピボタル:6試験、シングルアーム:6試験)の臨床試験があります。シングルアームのうち1試験はピボタル試験、残りはPMSです。
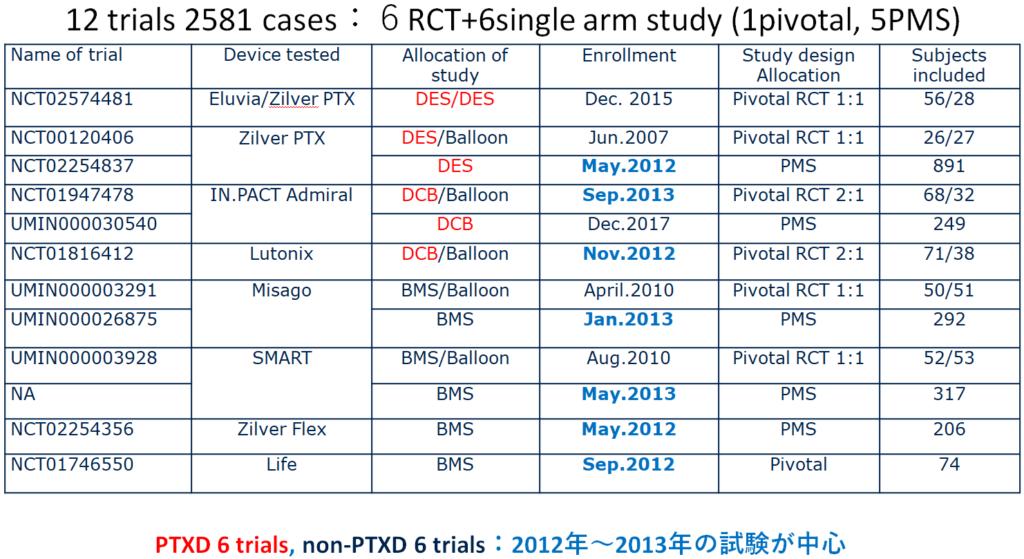
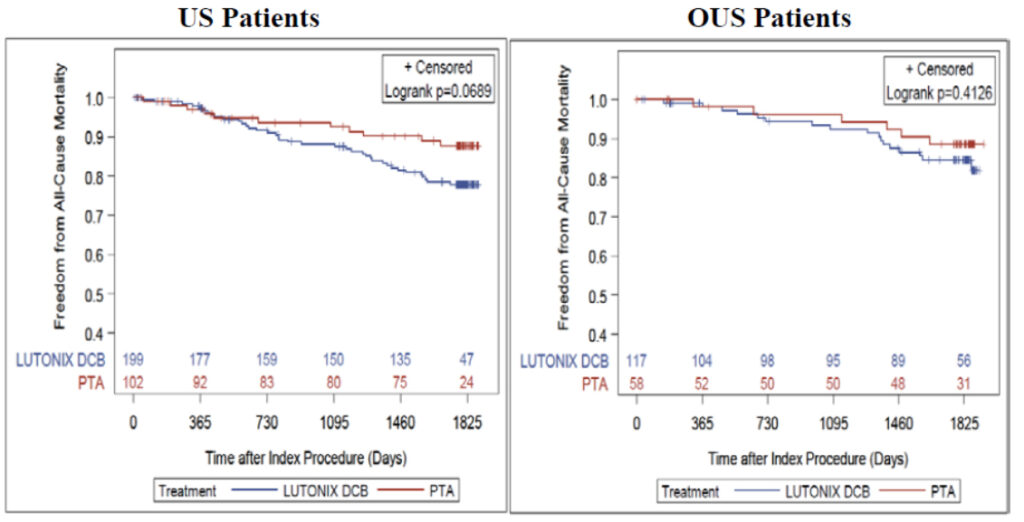
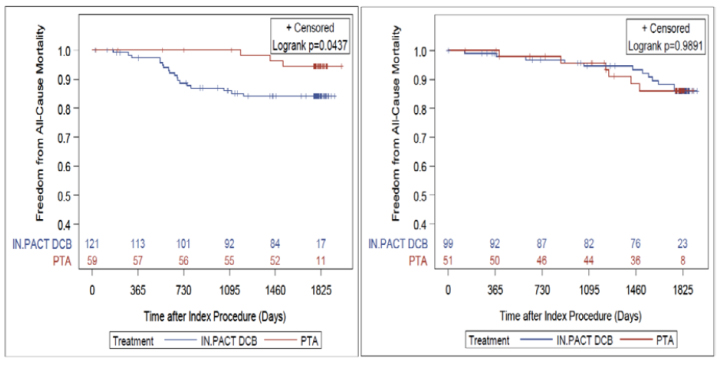
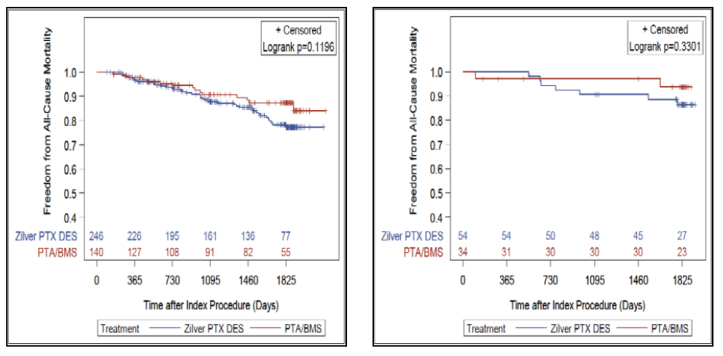
Overallの成績をみると、パクリタキセル群のほうが好成績だったという結果になっています。症例数は1,192例対1,389例と偏りはなく、ハザード比は1前後、p値も0.9程度とほぼ差がありません。
オープンラベルですから選択バイアスは解決できませんし、単群試験が入ってしまったのでミックスデータではあります。またPMSはかなり脱落例があるなど指摘される部分はありますが、従来の統計学上の欠点のいくつかは解決できたと思っています。
RCTは552例で、249例のパクリタキセル関連デバイスに対して非パクリタキセル関連デバイスが303例です。RCTは全て承認試験です。死亡率が11.7%対15.4%、ハザード比が0.813、p値が0.5109で全く差がみられません。
使用成績調査(PMS)は全部で2,029例、5年生存率は26.4%と31.0%で、むしろパクリタキセル関連デバイスが若干よいという成績になっています。シングルアームはもともとバイアスがかかった集団ですし、そこに調節因子を加えていくと症例数が減っていってデータとして使えないものが増えてしまいます。もともと設計された試験ではないので、市販後成績調査(PMS)を使うのは難しいというところは否めないと思っています。
今回の解析を終えての感想です。まず、症例数が多くなったので統計上の信頼性は向上しました。また、単群試験が組み込まれたことで実臨床の成績がかなり反映されていて、そこで差がないことがある程度示されました。そして対照群とのアンバランスが解消されたことがメリットとして挙げられます。
一方、missing data、ブランクデータで項目がなかなか統一しがたいこと、試験によって定義が異なっていること、薬剤の情報からくるバイアスの否定が困難であることが問題点と言えます。今回こうした解析を経験し、成功した要因や、問題点のクローズアップできたのではないかと思います。
積み重ねてきたPMSのデータが功を奏した
横井:
この結果で、現在のパクリタキセル関連デバイスを取り巻く状況がかなり改善されるのではないでしょうか。
先日のARIAや日本血管外科学会でも、中村先生がまとめた日本人のデータは現時点において最も信頼できるもので、全く独立した組織で解析した信頼できるデータということからも、患者さんにインフォームドコンセントをするときに大変助かるという声が多く聞かれました。このデータが出てきた一番のインパクトはそこにあると思います。
RCTとレジストリの統合解析について意見があるかもしれませんが、かなりスペクトラムの広い日本人患者層に対するデータ解析になりますので、臨床医としてはより信頼できるものだと感じます。
また、ここで改めて東北大学のアカデミックパワーとBMSのPMSのデータを要求してきたPMDA、真面目に遂行してくれた各企業にも感謝申し上げたいと心から思います。特に、日本は独自の判断をすると外資企業に明確にメッセージを出したPMDAの姿勢は大きかったと思いました。
中村:
患者さんに、データに基づいた安全という感触を提示できることは非常に大きなメリットですね。私も、行政からのプッシュが大きな後押しになったと思います。行政に協力いただいたことを本当に感謝申し上げますし、一生懸命データを出してくださった企業の方にも深く感謝いたします。
上野:
今回の解析で、ピュアな集団のRCTのデータから生まれたこれまでのガイドラインと、実臨床の患者さんたちは違う集団だということがよく見て取れたのではないかという気がしています。これを一つの足がかりとして、システムづくりが今後もやれるような形を残す方向のために「あすなろ会」はあるのだと実感しています。
香坂:
横井先生からCVITの中の学術データ、EVTレジストリが使用できるのではないかという話をかなり初期にいただきましたが、ハードルが高くて、今回はEVTレジストリを使用しないことになりました。
現在、EVTは飯田先生にアップデートを進めていただいているので、レジストリも充実化に努めていきたいと思っています。
中村:
今回の経験から重要項目の見当はつきましたので、次のステップには、それを漏れなく疾病調査に入れる、あるいはアップデートをより充実させるなどが重要だと考えています。
データの取りまとめに苦労した要因
池田:
データの数が多いということもありますが、データをまとめていた高田先生がなによりも苦労していたのは、定義の異なりやブランクデータの多さなどだと思います。時間が限られているのに何度もクエリーを出して確認という作業を繰り返し、ひとつひとつの項目の定義や数え方の統一に想像以上にとても時間がかかって、かなり労力を割いている様子が感じられました。
それでも、これをやってみた経験はすごく大きかったと思います。契約の煩雑さもそうですし、企業ごとの契約に対する考え方がわかりました。
結局自国から出したのは米国と日本だけですね。解析をすぐ出せたのは蓄積されたPMSのデータが残っていたからなので、すごくラッキーだったと思います。日本で臨床データを出していくことが、早いかたちで国民に還元できることにもつながるということは一つの可能性を感じているところです。
中村:
皆さんの意見のとおりです。BMSのPMSは無駄ではなかったということです。いま後ろ向きに見て役に立ったというのではなく、役に立つような臨床試験をやるべきだと思います。
鈴木:
また、定義を合わせておくことの重要性が身に沁みました。今後この経験を踏まえて、同一のプラットフォーム、プロトコルになればいいですね。BMSとDESでは患者背景がかなり異なっていてDESのほうが重篤な患者さんが入っているにもかかわらず、overall deathは変わらないというところは非常に意味があるのではないかと思います。
今回パクリタキセルを使った、日本で利用できるデータをすべて集めて解析できたことは、本当にすばらしいと思います。産官学の協力でなし得た事実は、世界にもアピールできるのではないかと感じます。
土井:
今回の解析に当たった東北大学の先生方はPMSという歯抜けだらけのデータを調整していったわけで、相当の労力をかけられたことは忘れてはいけないと思います。このパクリタキセルのPMSの成果は、世界の人が認めるべきものだと信じます。
中村:
いろんな過程を経て、様々なサポートとご指導があって達成できたことは本当に意義深いと感じます。石井先生、想定範囲内の達成か、想定されたプロセスよりも思った以上に大変だったのか、PMSの利活用を含めてご意見があればお願いします。
石井:
PMSのデータはGPSPを遵守したものですし、PMSの制度は日本独自のものですので、ぜひその有効活用をしていただければと私自身は感じていました。また、今回の取り組みはいろいろな課題を明確にしてくれたのではないかと思っています。まず、東北大学の先生方が大変苦労されたことです。PMSにしろ、アカデミアが主導するレジストリにしろ、プラットフォームの統一化や調査項目の標準化など、ルールづくりをしていかなければならないと思います。
今後も何年後かにまたこういう課題が出てくるのではないかと思いますので、そのときに備えてレジストリや企業のPMSのあり方を考えるよい機会ではないかと思います。
これからのPMSはどうあるべきか
中村:
PMSは企業にとっては金銭的にも人的資源的にも相当重荷で、5年フォローアップともなれば、製品寿命は終わっているのにデータは取り続けることになってしまいます。しかし皮肉にも、そのデータがあったからこそパクリタキセルの解析がうまくいったということですね。今後はPMSをどう扱っていけばよいでしょうか。
里見:
規制当局として、今後も産官学が一体となって対応することは大変重要だと思っています。
安全対策の立場として申し上げたいのは、今回の行政の対応はあまり特別なことと感じていないということです。海外の規制当局から出された声明をそのまま日本でも、ということではなく、日本では日本のデータをはっきりさせるということは、われわれの安全対策の考え方に沿ったものだと思っています。
中井:
学会と規制当局の連携という点の重要性が改めて感じられたと思います。幸いにも、インターベンション関係の先生方とPMDAは昔から仲がよかったですし、今回は日本独特のチーム関係でうまくいったのだろうと感じられずにはいられません。
そして、今回の成功例がこれだけで終わるのはもったいない気がします。市販前と市販後のリバランスと言われていますが、今回の事例は一つのモデルになるだろうと思いました。
俵木:
今回の件に関わったすべての人が一生懸命やってくださったと思います。行政もきちんと反応しましたし、研究費も出たということですばらしいかぎりです。
今回のPMDAのアクションは非常にすばらしかったなと思うのに、それが「特別なことと感じていない」というのはさらにすばらしいことです。
私が安全対策をやっていたころは、データが手持ちになければ、とりあえずFDAの解析を待つという風潮で、厚生労働省やPMDAが情報がない中で何かを表明することはありませんでした。今回、両者がスタンスをきちんと示してくれたことは、PMDAもいいパフォーマンスを示せる組織になってきた証だと感じます。
また、厚生労働省は現在デジタルヘルスに注力しています。マイナンバーカードが保険証として使え、電子処方箋で個人が自分のデータを持ち歩ける世界がやってくるのです。
しっかりとしたセキュリティの下に、個人データを厚生労働省が2次データとして使えるような標準化を進めていっていただきたいと思います。それができないといつまでも米国主導といわれてしまいます。レジストリをやるにしてもデータの標準化ができていれば楽になりますね。
中村:
学会主導のレジストリにしても医者の力のみで5年全例集めるのはまず不可能です。単なる努力では50%も集まらないのではないでしょうか。
最後に
中村:
さて、大規模RCTを解析したという最近の報告を2つ紹介します。
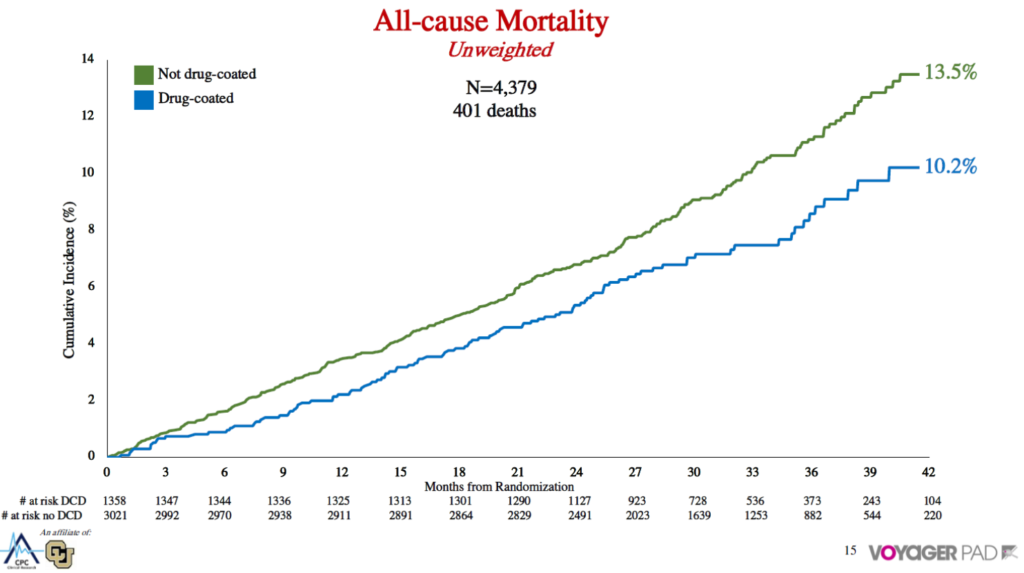
1つ目はVoyager PADで、これはリバーロキサバンの日本では承認されていない低用量の試験です。そのサブ解析でdrug-coatedデバイスとnot drug-coatedデバイスを比較したものです。
All-cause deathは13.5%対10.2%で、drug-coatedのほうがよかった。ただアジャストすると全く差がないという結果です。フォローアップが99%と非常に高いことから、企業の本気が分かります。
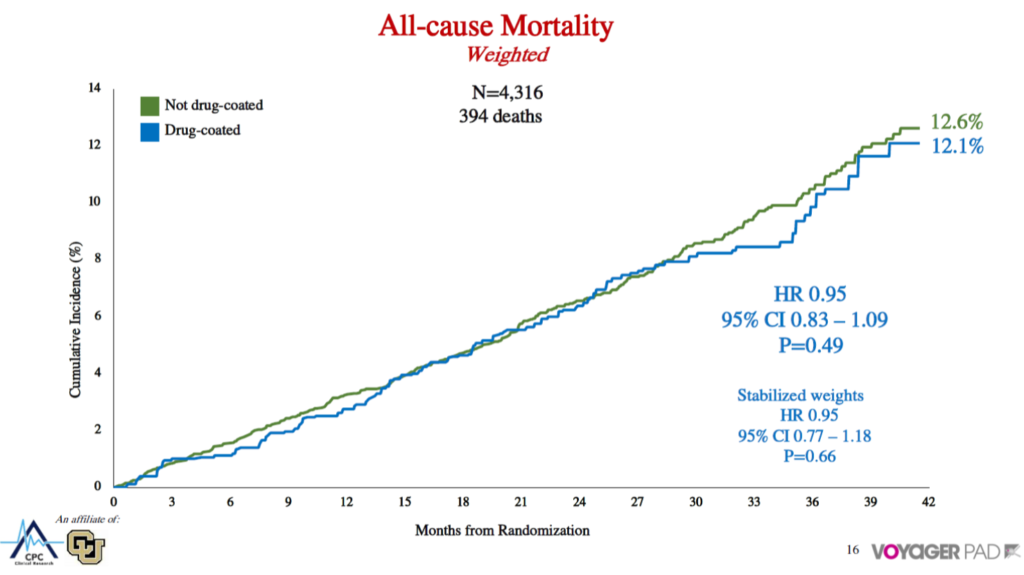
2つ目はSWED PADで、これはパクリタキセルの件が始まる前に臨床試験が行われていました。Drug-coated deviceとそれ以外のデバイスの比較検討試験が進行していたのですが、パクリタキセル問題で臨床試験が止まってしまいました。
最近になって臨床試験が再開されたのですが、今回の報告はいままでに登録したものの中間解析です。症例数は2000例、RCT、Overall、CLTI、跛行で全く差がありません。
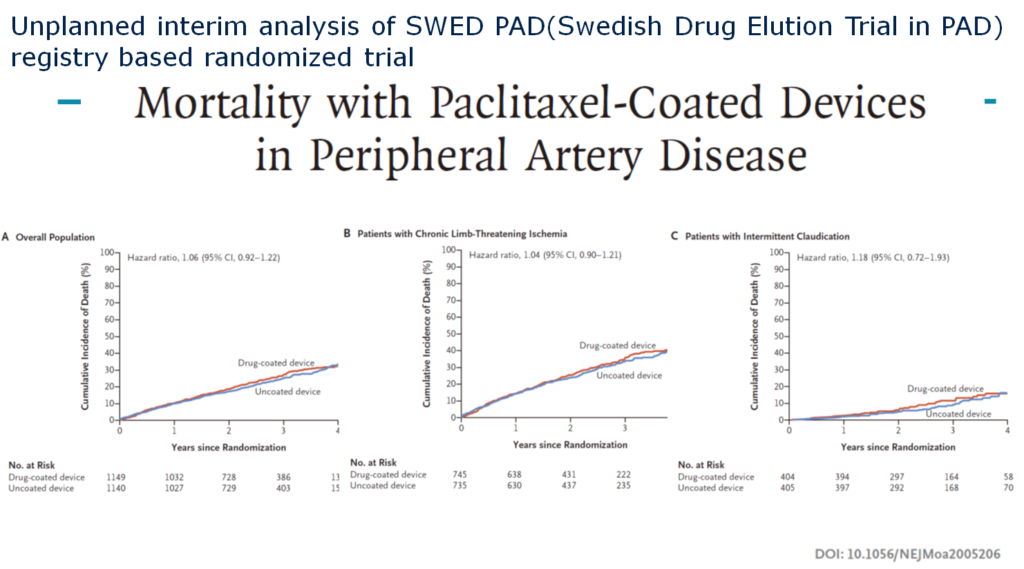
この2つのRCTの解析からは、パクリタキセル問題は実は世界的に差がなくて、米国で偶然悪いというデータが出ただけという気がしないでもありません。
さらに、これらの結果は今回のわれわれの解析結果とほぼ一致していて、今回の成績の確信を持てたという気がしています。
こういった結果を受けて、迅速な対応はなにかということですが、これは次のセッションで、意見交換していきたいと思います。
次回 【テーマ2】DES留置後のDAPT短縮と単剤